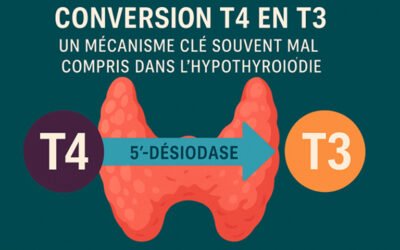
Hypothyroïdie : Pourquoi la conversion de la T4 en T3 est un maillon si crucial ?

Chez de nombreux patients traités pour une hypothyroïdie, les symptômes persistent malgré des dosages hormonaux corrects en apparence. Fatigue inexpliquée, troubles cognitifs, prise de poids résistante… Ces signes peuvent refléter une conversion incomplète de la thyroxine (T4) en triiodothyronine (T3) – la forme active de l’hormone thyroïdienne.
Rappels : pourquoi la T3 est-elle si essentielle ?
La T3 est 10 à 15 fois plus active que la T4. Elle se lie directement aux récepteurs nucléaires des cellules cibles pour activer la transcription des gènes impliqués dans la production d’énergie, la thermorégulation, la croissance cellulaire et la fonction cognitive.
Environ 80 % de la T3 circulante est produite par conversion périphérique de T4, essentiellement dans le foie, les reins, les muscles et le cerveau.
Le rôle des désiodases
Trois enzymes sont responsables de la régulation hormonale :
- D1 : conversion T4 → T3 dans foie, rein, thyroïde
- D2 : production intracellulaire de T3 dans cerveau, hypophyse, tissu adipeux brun
- D3 : inactivation des hormones thyroïdiennes (T4 en rT3, T3 en T2)
La 5′-désiodase (D1 et D2) dépend de plusieurs cofacteurs nutritionnels, notamment le sélénium, le zinc, le magnésium, et sa régulation est sensible aux facteurs métaboliques et environnementaux.
Les freins à la conversion de T4 en T3
Carences nutritionnelles
Les déficits en micronutriments ralentissent la désiodation.
- Le sélénium est un cofacteur indispensable de la désiodase et un modulateur immunitaire.
- Le zinc est impliqué dans la synthèse hormonale.
- Le magnésium soutient la fonction enzymatique.
- Le fer est nécessaire à l’activité de la TPO.
- Les vitamines B participent à la régulation métabolique.
Stress chronique
Le cortisol en excès inhibe la D1, active la D3, et favorise la production de reverse T3 (rT3), une forme inactive.
Fonction hépatique et rénale
Le foie et les reins, principaux lieux de conversion, peuvent être limitants en cas de pathologie chronique (stéatose, insuffisance rénale…).
Implications cliniques
Chez un patient traité par Lévothyroxine® avec une TSH normalisée mais des symptômes persistants, il peut être utile de doser :
- T3 libre
- T4 libre
- Reverse T3 (en laboratoire spécialisé)
Ces dosages permettent de détecter un déficit fonctionnel en T3 malgré une TSH dans les normes.
Supplémentation ciblée : une approche fondée sur les données scientifiques
Des études cliniques ont montré les effets bénéfiques de certains micronutriments et extraits de plantes :
- Sélénium
Indispensable à la 5’-désiodase. Une méta-analyse (Wichman et al., 2016) a montré une diminution significative des anticorps anti-TPO chez les patients hypothyroïdiens auto-immuns supplémentés.
- Zinc
Participe à la conversion T4 → T3. Une étude (Mahmoodianfard, 2015) a démontré une amélioration du profil hormonal avec une supplémentation combinée zinc-sélénium.
- Magnésium
Cofacteur de nombreuses réactions enzymatiques. Une étude (Wang, 2018) montre qu’un déficit est associé à une élévation du risque d’hypothyroïdie.
- Fer
Nécessaire à la TPO. Des taux bas de ferritine sont associés à une élévation de la TSH et à la survenue de goitre (Mishra, 2018).
- Vitamine D
Favorise l’expression cellulaire de la T3. Une supplémentation de 50 000 UI/sem pendant 12 semaines a permis une baisse significative de la TSH (Talaei, 2018).
- Ashwagandha
Plante adaptogène. Une étude randomisée contre placebo (Sharma, 2018) a montré une baisse de la TSH et une augmentation significative de T3 et T4 après 8 semaines à 600 mg/j.
Conclusion
La conversion de T4 en T3 est un processus biologique central dans l’expression de la fonction thyroïdienne. Une TSH normale ne garantit pas une activité hormonale suffisante en aval. Une prise en charge efficace de l’hypothyroïdie peut nécessiter une approche intégrative, associant traitement hormonal et soutien nutritionnel ciblé pour rétablir une conversion optimale et améliorer la qualité de vie des patients.
Références
- Bianco AC et al. Endocrine Reviews, 2002
- Peeters RP, Nat Rev Endocrinol, 2005
- Gereben B et al., Endocr Rev, 2008
- Wichman J et al., Thyroid, 2016;26(12):1681–1692
- Mahmoodianfard S et al., J Am Coll Nutr, 2015;34(5):391–399
- Wang K et al., Scientific Reports, 2018;8(1):9904
- Mishra AK et al., Int J Adv Med, 2018;5(2):359–363
- Cimino JA et al., Metabolism, 1998;47:89–93
- Apeland T et al., Clin Biochem, 2006;39(3):282–286
- Collins AB, Pawlak R, Asia Pac J Clin Nutr, 2016;25(2):221–226
- Fliers E et al., Lancet, 2006;367(9506):764–774
- Escobar-Morreale HF et al., Clin Endocrinol, 1996
- Wartofsky L, Endocr Pract, 2006;12(5):456–463
- Talaei A et al., Indian J Endocrinol Metab, 2018;22(5):584–588
- Sharma AK et al., JACM, 2018;24(3):243–248
Inscrivez-vous à la Newsletter
Et recevez un bon d’achat de 5€ à utiliser lors de votre prochaine commande.